新闻来源:实验研究部
8月4日,我院实验研究部黄曦教授作为唯一通讯作者,在Nature Communications (中科院/JCR双一区学术期刊,最新公布影响因子15.7)上发表了题为“Lung metastasis and recurrence is mitigated by CAR macrophages, in-situ-generated from mRNA delivered by small extracellular vesicles”的重要研究论文。该研究开发了一种创新的可吸入式基因递送系统,为治疗癌症肺转移和防止复发提供了一种全新、高效且安全的免疫治疗策略。
癌症转移和复发是导致患者死亡的主要原因,其中肺部是最常见的转移靶器官。尽管CAR-T细胞疗法在血液肿瘤中效果显著,但在实体瘤治疗中仍面临诸多瓶颈。黄曦教授团队独辟蹊径,将目光投向了具有强大肿瘤浸润和吞噬能力的巨噬细胞,致力于开发新一代的嵌合抗原受体巨噬细胞(CAR-M)疗法。
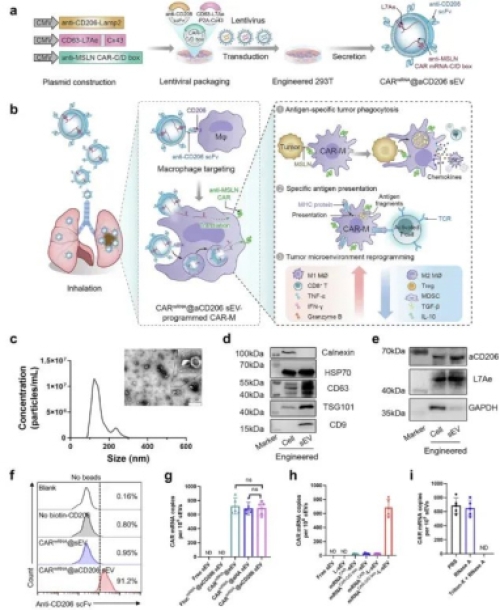
传统的CAR-M制造工艺复杂,且细胞通过静脉注射后大多滞留在肝脏,难以有效到达肺部病灶。针对这一难题,黄曦教授团队设计了一种巧妙的“原位改造”方案:他们成功构建了一种工程化的小细胞外囊泡(sEV),其表面整合了靶向巨噬细胞的抗体(抗CD206 scFv),内部装载了可编码识别肿瘤抗原间皮素的CAR结构的mRNA。
研究表明,通过吸入方式给药,这些被命名为“CARmRNA@aCD206 sEV”的微小囊泡能够高效地在肺组织富集,并精准地将CAR mRNA递送至肺部的巨噬细胞中。这些被“改造”的巨噬细胞成功转变为具有强大抗癌能力的CAR-M细胞。在肺转移癌小鼠模型中,该疗法有效抑制了肿瘤生长,并成功激发了机体的长效免疫记忆,显著预防了肿瘤复发,延长了生存时间。
该项研究的创新性在于:
1.给药途径创新:变复杂的体外细胞制备和静脉输注为简便的“吸入”给药,极大提升了治疗的可及性和便利性。
2.递送系统创新:利用生物相容性好的sEV作为载体,实现mRNA的高效、精准递送,避免了传统载体的毒性和靶向性差的问题。
3.治疗策略创新:“体内原位编程”技术利用体内庞大的巨噬细胞资源,将其直接重编程为抗癌“战士”,解决了细胞来源、肝部滞留等多重难题。
该研究成果是细胞免疫治疗领域的一项重大突破,不仅为肺转移癌患者带来了新的希望,也极大推动了CAR技术在实体瘤治疗中的临床应用前景。它标志着我院在肿瘤免疫治疗基础研究与转化应用方面取得了又一里程碑式的进展。
论文链接:
https://pubmed.ncbi.nlm.nih.gov/40759657/
图:CARmRNA@aCD206 sEVs的制备及作用机制示意图
(图片来源: Nature Communications)
审稿专家:黄曦 陈守登
通讯员:李雪洋